quimica
Questões de química
-
Cadastre-se
Questão 1 – Funções orgânicas
Uma forma de organização de um sistema biológico é a presença de sinais diversos utilizados pelos indivíduos para se comunicarem. No caso das abelhas da espécie Apis mellifera, os sinais utilizados podem ser feromônios. Para saírem e voltarem de suas colmeias, usam um feromônio que indica a trilha percorrida por elas (Composto A). Quando pressentem o perigo, expelem um feromônio de alarme (Composto B), que serve de sinal para um combate coletivo. O que diferencia cada um desses sinais utilizados pelas abelhas são as estruturas e funções orgânicas dos feromônios.
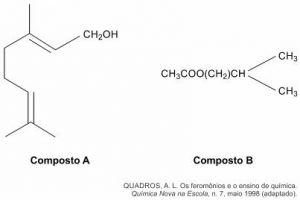
As funções orgânicas que caracterizam os feromônios de trilha e de alarme são, respectivamente,
-
Cadastre-se
Questão 2 – Funções orgânicas
O glifosato (C3H8NO5P) é um herbicida pertencente ao grupo químico das glicinas, classificado como não seletivo. Esse composto possui os grupos funcionais carboxilato, amino e fosfonato. A degradação do glifosato no solo é muito rápida e realizada por grande variedade de microrganismos, que usam o produto como fonte de energia e fósforo. Os produtos da degradação são o ácido aminometilfosfônico (AMPA) e o N-metilglicina (sarcosina):

A partir do texto e dos produtos de degradação apresentados, a estrutura química que representa o glifosato é:
-
Cadastre-se
Questão 3 – Funções orgânicas
A produção mundial de alimentos poderia se reduzir a 40% da atual sem a aplicação de controle sobre as pragas agrícolas. Por outro lado, o uso frequente dos agrotóxicos pode causar contaminação em solos, águas superficiais e subterrâneas, atmosfera e alimentos. Os biopesticidas, tais como a piretrina e coronopilina, têm sido uma alternativa na diminuição dos prejuízos econômicos, sociais e ambientais gerados pelos agrotóxicos.
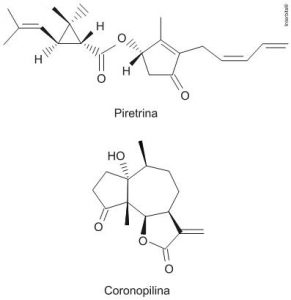
Identifique as funções orgânicas presentes simultaneamente nas estruturas dos dois biopesticidas apresentados:
-
Cadastre-se
Questão 4 – Funções orgânicas
Os pesticidas modernos são divididos em várias classes, entre as quais se destacam os organofosforados, materiais que apresentam efeito tóxico agudo para os seres humanos. Esses pesticidas contêm um átomo central de fósforo ao qual estão ligados outros átomos ou grupo de átomos como oxigênio, enxofre, grupos metoxi ou etoxi, ou um radical orgânico de cadeia longa. Os organofosforados são divididos em três subclasses: Tipo A, na qual o enxofre não se incorpora na molécula; Tipo B, na qual o oxigênio, que faz dupla ligação com fósforo, é substituído pelo enxofre; e Tipo C, no qual dois oxigênios são substituídos por enxofre.
BAIRD, C. Química Ambiental. Bookman, 2005.
Um exemplo de pesticida organofosforado Tipo B, que apresenta grupo etoxi em sua fórmula estrutural, está representado em:
-
Cadastre-se
Questão 5 – Funções orgânicas
A curcumina, substância encontrada no pó-amarelo-alaranjado extraído da raiz da cúrcuma ou açafrão-da-índia (Curcuma longa), aparentemente, pode ajudar a combater vários tipos de câncer, o mal de Alzheimer e até mesmo retardar o envelhecimento. Usada há quatro milênios por algumas culturas orientais, apenas nos últimos anos passou a ser investigada pela ciência ocidental.
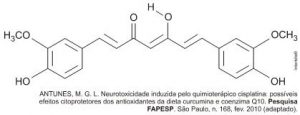
Na estrutura da curcumina, identificam-se grupos característicos das funções
-
Cadastre-se
Questão 1 – Química ambiental
A liberação dos gases clorofluorcarbonos (CFCs) na atmosfera pode provocar depleção de ozônio na estratosfera. O ozônio estratosférico é responsável por absorver parte da radiação ultravioleta emitida pelo Sol, a qual é nociva aos seres vivos. Esse processo, na camada de ozônio, é ilustrado simplificadamente na figura.
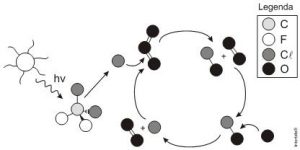
Quimicamente, a destruição do ozônio na atmosfera por gases CFCs é decorrência da
-
Cadastre-se
Questão 2 – Química ambiental
O rótulo de um desodorante aerossol informa ao consumidor que o produto possui em sua composição os gases isobutano, butano e propano, dentre outras substâncias. Além dessa informação, o rótulo traz, ainda, a inscrição “Não tem CFC”. As reações a seguir, que ocorrem na estratosfera, justificam a não utilização de CFC (clorofluorcarbono ou Freon) nesse desodorante:
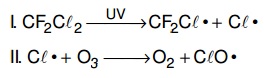
A preocupação com as possíveis ameaças à camada de ozônio (O3) baseia-se na sua principal função: proteger a matéria viva na Terra dos efeitos prejudiciais dos raios solares ultravioleta. A absorção da radiação ultravioleta pelo ozônio estratosférico é intensa o suficiente para eliminar boa parte da fração de ultravioleta que é prejudicial à vida.
A finalidade da utilização dos gases isobutano, butano e propano neste aerossol é
-
Cadastre-se
Questão 3 – Química ambiental
Um dos processos usados no tratamento do lixo é a incineração, que apresenta vantagens e desvantagens. Em São Paulo, por exemplo, o lixo é queimado a altas temperaturas e parte da energia liberada é transformada em energia elétrica. No entanto, a incineração provoca a emissão de poluentes na atmosfera. Uma forma de minimizar a desvantagem da incineração, destacada no texto, é
-
Cadastre-se
Questão 4 – Química ambiental
Potencializado pela necessidade de reduzir as emissões de gases causadores do efeito estufa, o desenvolvimento de fontes de energia renováveis e limpas dificilmente resultará em um modelo hegemônico. A tendência é que cada país crie uma combinação própria de matrizes, escolhida entre várias categorias de biocombustíveis, a energia solar ou a eólica e, mais tarde, provavelmente o hidrogênio, capaz de lhe garantir eficiência energética e ajudar o mundo a atenuar os efeitos das mudanças climáticas. O hidrogênio, em um primeiro momento, poderia ser obtido a partir de hidrocarbonetos ou de carboidratos.
Disponível em: <http://www.revistapesquisa.fapesp.br>. Acesso em: mar. 2007 (adaptado).
Considerando as fontes de hidrogênio citadas, a de menor impacto ambiental seria
-
Cadastre-se
Questão 5 – Química ambiental
O processo de industrialização tem gerado sérios problemas de ordem ambiental, econômica e social, entre os quais se pode citar a chuva ácida. Os ácidos usualmente presentes em maiores proporções na água da chuva são o H2CO3, formado pela reação do CO2 atmosférico com a água, o HNO3, o HNO2, o H2SO4 e o H2SO3. Esses quatro últimos são formados principalmente a partir da reação da água com os óxidos de nitrogênio e de enxofre gerados pela queima de combustíveis fósseis.
A formação de chuva mais ou menos ácida depende não só da concentração do ácido formado, como também do tipo de ácido. Essa pode ser uma informação útil na elaboração de estratégias para minimizar esse problema ambiental. Se consideradas concentrações idênticas, quais dos ácidos citados no texto conferem maior acidez às águas das chuvas?
-
Cadastre-se
Questão 1 – Cálculo Estequiométrico
A minimização do tempo e custo de uma reação química, bem como o aumento na sua taxa de conversão, caracteriza a eficiência de um processo químico. Como consequência, produtos podem chegar ao consumidor mais baratos. Um dos parâmetros que mede a eficiência de uma reação química é o seu rendimento molar (R, em %), definido como

em que n corresponde ao número de mols. O metanol pode ser obtido pela reação entre brometo de metila e hidróxido de sódio, conforme a equação química:
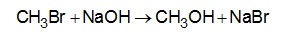
As massas molares (em g/mol) desses elementos são:
H=1; C=12; O=16; Na: 23; Br= 80.
O rendimento molar da reação, em que 32g de metanol foram obtidos a partir de 142,5g de brometo de metila e 80g de hidróxido de sódio, é mais próximo de
-
Cadastre-se
Questão 2 – Cálculo Estequiométrico
O cobre presente nos fios elétricos e instrumentos musicais é obtido a partir da ustulação do minério calcosita (Cu2S). Durante esse processo, ocorre o aquecimento desse sulfeto na presença de oxigênio, de forma que o cobre fique “livre” e o enxofre se combine com o O2 produzindo SO2 conforme a equação química:
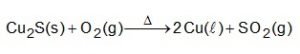
As massas molares dos elementos Cu e S são, respectivamente, iguais a 63,5 g/mol e 32 g/mol.
CANTO, E. L. Minerais, minérios, metais: de onde vêm?, para onde vão? São Paulo: Moderna, 1996 (adaptado).
Considerando que se queira obter 16 mols do metal em uma reação cujo rendimento é de 80% a massa, em gramas, do minério necessária para obtenção do cobre é igual a
-
Cadastre-se
Questão 3 – Cálculo Estequiométrico
Grandes fontes de emissão do gás dióxido de enxofre são as indústrias de extração de cobre e níquel, em decorrência da oxidação dos minérios sulfurados. Para evitar a liberação desses óxidos na atmosfera e a consequente formação da chuva ácida, o gás pode ser lavado, em um processo conhecido como dessulfurização, conforme mostrado na equação (1).

Por sua vez, o sulfito de cálcio formado pode ser oxidado, com o auxílio do ar atmosférico, para a obtenção do sulfato de cálcio, como mostrado na equação (2). Essa etapa é de grande interesse porque o produto da reação, popularmente conhecido como gesso, é utilizado para fins agrícolas.
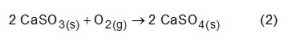
As massas molares dos elementos carbono, oxigênio, enxofre e cálcio são iguais a 12 g/mol, 16 g/mol, 32 g/mol e 40 g/mol respectivamente.
BAIRD, C. Química ambiental. Porto Alegre: Bookman. 2002 (adaptado).
Considerando um rendimento de 90% no processo, a massa de gesso obtida, em gramas, por mol de gás retido é mais próxima de
-
Cadastre-se
Questão 4 – Cálculo Estequiométrico
O bisfenol-A é um composto que serve de matéria-prima para a fabricação de polímeros utilizados em embalagens plásticas de alimentos, em mamadeiras e no revestimento interno de latas. Esse composto está sendo banido em diversos países, incluindo o Brasil, principalmente por ser um mimetizador de estrógenos (hormônios) que, atuando como tal no organismo, pode causar infertilidade na vida adulta. O bisfenol-A (massa molar igual a 228 g/mol) é preparado pela condensação da propanona (massa molar igual a 58 g/mol) com fenol (massa molar igual a 94 g/mol) em meio ácido, conforme apresentado na equação química.
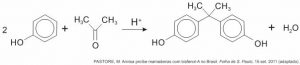
Considerando que, ao reagir 580g de propanona com 3760g de fenol, obteve-se 1,14kg de bisfenol-A, de acordo com a reação descrita, o rendimento real do processo foi de
-
Cadastre-se
Questão 5 – Cálculo Estequiométrico
A composição média de uma bateria automotiva esgotada é de aproximadamente 32% Pb, 3% PbO, 17% PbO2 e 36% PbSO4. A média de massa da pasta residual de uma bateria usada é de 6kg, onde 19% é PbO2, 60% PbSO4 e 21% Pb. Entre todos os compostos de chumbo presentes na pasta, o que mais preocupa é o sulfato de chumbo (II), pois nos processos pirometalúrgicos, em que os compostos de chumbo (placas das baterias) são fundidos, há a conversão de sulfato em dióxido de enxofre, gás muito poluente.
Para reduzir o problema das emissões de SO2(g), a indústria pode utilizar uma planta mista, ou seja, utilizar o processo hidrometalúrgico, para a dessulfuração antes da fusão do composto de chumbo. Nesse caso, a redução de sulfato presente no PbSO4 é feita via lixiviação com solução de carbonato de sódio (Na2CO3) 1M a 45°C, em que se obtém o carbonato de chumbo (II) com rendimento de 91%. Após esse processo, o material segue para a fundição para obter o chumbo metálico.
PbSO4 + Na2CO3 → PbCO3 + Na2SO4
Dados: Massas Molares em g/mol Pb = 207; S = 32; Na = 23; O = 16; C = 12
ARAÚJO, R.V.V.; TINDADE, R.B.E.; SOARES, P.S.M. Reciclagem de chumbo de bateria automotiva: estudo de caso. Disponível em: http://www.iqsc.usp.br. Acesso em: 17 abr. 2010 (adaptado).
Segundo as condições do processo apresentado para a obtenção de carbonato de chumbo (II) por meio da lixiviação por carbonato de sódio e considerando uma massa de pasta residual de uma bateria de 6 kg, qual quantidade aproximada, em quilogramas, de PbCO3 é obtida?
-
Cadastre-se
Questão 1 – Eletroquímica
Texto I
Biocélulas combustíveis são uma alternativa tecnológica para substituição das baterias convencionais. Em uma biocélula microbiológica, bactérias catalisam reações de oxidação de substratos orgânicos. Liberam elétrons produzidos na respiração celular para um eletrodo, onde fluem por um circuito externo até o cátodo do sistema, produzindo corrente elétrica. Uma reação típica que ocorre em biocélulas microbiológicas utiliza o acetato como substrato.
AQUINO NETO. S. Preparação e caracterização de bioanodos para biocélula e combustível etanol/O2 Disponível em: www.teses.usp.br. Acesso em: 23 jun. 2015 (adaptado).
Texto II
Em sistemas bioeletroquímicos, os potenciais padrão (Eo‘) apresentam valores característicos. Para as biocélulas de acetato, considere as seguintes semirreações de redução e seus respectivos potenciais:
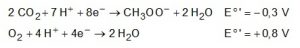
SCOTT, K.; YU, E. H. Microbial electrochemical and fuel cells: fundamentals and applications. Woodhead Publishing Series in Energy. n. 88, 2016 (adaptado).
Nessas condições, qual é o número mínimo de biocélulas de acetato, ligadas em série, necessárias para se obter uma diferença de potencial de 4,4V?
-
Cadastre-se
Questão 2 – Eletroquímica
O alumínio é um metal bastante versátil, pois, a partir dele, podem-se confeccionar materiais amplamente utilizados pela sociedade. A obtenção do alumínio ocorre a partir da bauxita, que é purificada e dissolvida em criolita fundida (Na3AlF6) e eletrolisada a cerca de 1000 °C. Há liberação do gás dióxido de carbono (CO2) formado a partir da reação de um dos produtos da eletrólise com o material presente nos eletrodos. O ânodo é formado por barras de grafita submergidas na mistura fundida. O cátodo é uma caixa de ferro coberta de grafita. A reação global do processo é:
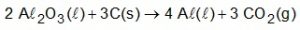
Na etapa de obtenção do alumínio líquido, as reações que ocorrem no cátodo e ânodo são:
-
Cadastre-se
Questão 3 – Eletroquímica
A calda bordalesa é uma alternativa empregada no combate a doenças que afetam folhas de plantas. Sua produção consiste na mistura de uma solução aquosa de sulfato de cobre(II), CuSO4, com óxido de cálcio, CaO, e sua aplicação só deve ser realizada se estiver levemente básica. A avaliação rudimentar da basicidade dessa solução é realizada pela adição de três gotas sobre uma faca de ferro limpa. Após três minutos, caso surja uma mancha avermelhada no local da aplicação, afirma-se que a calda bordalesa ainda não está com a basicidade necessária. O quadro apresenta os valores de potenciais padrão de redução (Eo) para algumas semirreações de redução.

A equação química que representa a reação de formação da mancha avermelhada é: -
Cadastre-se
Questão 4 – Eletroquímica
A revelação das chapas de raios X gera uma solução que contém íons prata na forma de Ag(S2O3)23–. Para evitar a descarga desse metal no ambiente, a recuperação de prata metálica pode ser feita tratando eletroquimicamente essa solução com uma espécie adequada. O quadro apresenta semirreações de redução de alguns íons metálicos.

BENDASSOLLI, J. A. et al. “Procedimentos para a recuperação de Ag de resíduos líquidos e sólidos”. Química Nova, v. 26, n. 4, 2003 (adaptado).
Das espécies apresentadas, a adequada para essa recuperação é
-
Cadastre-se
Questão 5 – Eletroquímica
O boato de que os lacres das latas de alumínio teriam um alto valor comercial levou muitas pessoas a juntarem esse material na expectativa de ganhar dinheiro com sua venda. As empresas fabricantes de alumínio esclarecem que isso não passa de uma “lenda urbana”, pois ao retirar o anel da lata, dificulta-se a reciclagem do alumínio. Como a liga do qual é feito o anel contém alto teor de magnésio, se ele não estiver junto com a lata, fica mais fácil ocorrer a oxidação do alumínio no forno. A tabela apresenta as semirreações e os valores de potencial padrão de redução de alguns metais:
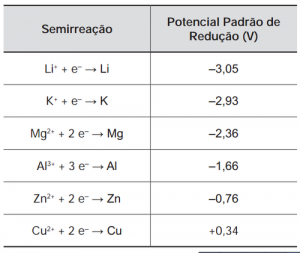
Disponível em: www.sucatas.com. Acesso em: 28 fev. 2012 (adaptado).
Com base no texto e na tabela, que metais poderiam entrar na composição do anel das latas com a mesma função do magnésio, ou seja, proteger o alumínio da oxidação nos fornos e não deixar diminuir o rendimento da sua reciclagem?
-
Cadastre-se
Questão 1 – Ligações Químicas
O carvão ativado é um material que possui elevado teor de carbono, sendo muito utilizado para a remoção de compostos orgânicos voláteis do meio, como o benzeno. Para a remoção desses compostos, utiliza-se a adsorção. Esse fenômeno ocorre por meio de interações do tipo intermoleculares entre a superfície do carvão (adsorvente) e o benzeno (adsorvato, substância adsorvida).
No caso apresentado, entre o adsorvente e a substância adsorvida ocorre a formação de:
-
Cadastre-se
Questão 2 – Ligações Químicas
Em sua formulação, o spray de pimenta contém porcentagens variadas de oleorresina de Capsicum, cujo principio ativo é a capsaicina, e um solvente (um álcool como etanol ou isopropanol). Em contato com os olhos, pele ou vias respiratórias, a capsaicina causa um efeito inflamatório que gera uma sensação de dor e ardor, levando à cegueira temporária. O processo é desencadeado pela liberação de neuropeptídios das terminações nervosas.
Como funciona o gás de pimenta. Disponível em: http://pessoas.hsw.uol.com.br. Acesso em: 1 mar. 2012 (adaptado).
Quando uma pessoa é atingida com o spray de pimenta nos olhos ou na pele, a lavagem da região atingida com água é ineficaz porque a
-
Cadastre-se
Questão 3 – Ligações Químicas
As fraldas descartáveis que contêm o polímero poliacrilato de sódio (1) são mais eficientes na retenção de água que as fraldas de pano convencionais, constituídas de fibras de celulose (2).
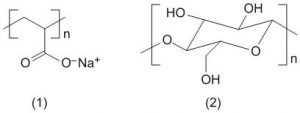
CURI, D. Química Nova na Escola, São Paulo, n. 23, maio 2006 (adaptado).
A maior eficiência dessas fraldas descartáveis, em relação às de pano, deve-se às
-
Cadastre-se
Questão 4 – Ligações Químicas
A fosfatidilserina é um fosfolipídio aniônico cuja interação com cálcio livre regula processos de transdução celular e vem sendo estudada no desenvolvimento de biossensores nanométricos. A figura representa a estrutura da fosfatidilserina:
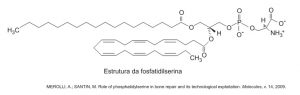
Com base nas informações do texto, a natureza da interação da fosfatidilserina com o cálcio livre é do tipo
Dado: número atômico do elemento cálcio: 20
-
Cadastre-se
Questão 5 – Ligações Químicas
Para lavar e refrescar o ambiente, que estava a uma pessoa resolveu jogar água sobre um piso de granito. Ela observou que o líquido se concentrou em algumas regiões, molhando parcialmente a superfície. Ao adicionar detergente sobre essa água, a pessoa verificou que o líquido se espalhou e deixou o piso totalmente molhado.
A molhabilidade da superfície foi melhorada em função da
Termoquímica
-
Cadastre-se
Introdução à termoquímica – processos endotérmicos e exotérmicos
Assista esse vídeo com o Prof. Felipe Custódio de Química, sobre Introdução à termoquímica – processos endotérmicos e exotérmicos pertencente ao módulo de Termoquímica e aprenda mais sobre o assunto.
-
Cadastre-se
Calor de formação e cálculo de H
Assista esse vídeo com o Prof. Felipe Custódio de Química, sobre Calor de formação e cálculo de H pertencente ao módulo de Termoquímica e aprenda mais sobre o assunto.
-
Cadastre-se
Calor de combustão
Assista esse vídeo com o Prof. Felipe Custódio de Química, sobre Calor de combustão pertencente ao módulo de Termoquímica e aprenda mais sobre o assunto.
-
Cadastre-se
Lei de Hess
Assista esse vídeo com o Prof. Felipe Custódio de Química, sobre Lei de Hess pertencente ao módulo de Termoquímica e aprenda mais sobre o assunto.
-
Cadastre-se
Energia de ligação no cálculo do H
Assista esse vídeo com o Prof. Felipe Custódio de Química, sobre Energia de ligação no cálculo do H pertencente ao módulo de Termoquímica e aprenda mais sobre o assunto.
Isomeria
-
Cadastre-se
Introdução à isomeria e isomeria plana de função, e de cadeia
Assista esse vídeo com o Prof. Wagner Oliveira de Química, sobre Introdução à isomeria e isomeria plana de função, e de cadeia pertencente ao módulo de Isomeria e aprenda mais sobre o assunto.
-
Cadastre-se
Isomeria plana de posição, metameria e tautomeria
Assista esse vídeo com o Prof. Wagner Oliveira de Química, sobre Isomeria plana de posição, metameria e tautomeria pertencente ao módulo de Isomeria e aprenda mais sobre o assunto.
-
Cadastre-se
Isomeria Geométrica ou cis-trans
Assista esse vídeo com o Prof. Wagner Oliveira de Química, sobre Isomeria Geométrica ou cis-trans pertencente ao módulo de Isomeria e aprenda mais sobre o assunto.
-
Cadastre-se
Isomeria óptica – enantiômeros
Assista esse vídeo com o Prof. Wagner Oliveira de Química, sobre Isomeria óptica – enantiômeros pertencente ao módulo de Isomeria e aprenda mais sobre o assunto.
-
Cadastre-se
As características da atmosfera e os principais conceitos
Assista esse vídeo com o Prof. Wagner Oliveira de Química, sobre As características da atmosfera e os principais conceitos pertencente ao módulo de Isomeria e aprenda mais sobre o assunto.
Funções Orgânicas
Resumo
Química orgânica Devido ao número de compostos orgânicos ser muito grande, faz-se necessário estudá-los em grupos. Esses grupos são formados por substâncias que apresentam propriedades químicas semelhantes. Esta semelhança é justificada pelo fato de as substâncias apresentarem afinidades estruturais. O átomo ou grupo de átomos que aparecem nas ...
-
Cadastre-se
Álcool, Fenol, Enol e Éter
Assista esse vídeo com o Prof. Felipe Custódio de Química, sobre Álcool, fenol, enol e éter pertencente ao módulo de Funções Orgânicas e aprenda mais sobre o assunto.
-
Cadastre-se
Cetona, Aldeído e Haleto orgânico
Assista esse vídeo com o Prof. Felipe Custódio de Química, sobre Cetona, aldeído e Haleto orgânico pertencente ao módulo de Funções Orgânicas e aprenda mais sobre o assunto.
-
Cadastre-se
Hidrocarbonetos
Assista esse vídeo com o Prof. Felipe Custódio de Química, sobre Hidrocarbonetos pertencente ao módulo de Funções Orgânicas e aprenda mais sobre o assunto.
-
Cadastre-se
Ácido carboxílico, Anidrido e Éster
Assista esse vídeo com o Prof. Felipe Custódio de Química, sobre Ácido carboxílico, Anidrido e Éster pertencente ao módulo de Funções Orgânicas e aprenda mais sobre o assunto.
-
Cadastre-se
Amina, Amida e Nitrocompostos
Assista esse vídeo com o Prof. Felipe Custódio de Química, sobre Amina, amida e nitrocompostos pertencente ao módulo de Funções Orgânicas e aprenda mais sobre o assunto.
Polímeros
-
Cadastre-se
Introdução aos polímeros – classificação dos polímeros
Assista esse vídeo com o Prof. Wagner Oliveira de Química, sobre Introdução aos polímeros – classificação dos polímeros. pertencente ao módulo de Polímeros e aprenda mais sobre o assunto.
-
Cadastre-se
Polímeros de adição – polietileno, policloreto de vinila, e teflon.
Assista esse vídeo com o Prof. Wagner Oliveira de Química, sobre Polímeros de adição – polietileno, policloreto de vinila, e teflon. pertencente ao módulo de Polímeros e aprenda mais sobre o assunto.
-
Cadastre-se
Polímeros de adição – poliestireno, polipropileno, e poliacetileno.
Assista esse vídeo com o Prof. Wagner Oliveira de Química, sobre Polímeros de adição – poliestireno, polipropileno, e poliacetileno. pertencente ao módulo de Polímeros e aprenda mais sobre o assunto.
-
Cadastre-se
Polímeros de adição – neopreno poliisopreno e polibutadieno
Assista esse vídeo com o Prof. Wagner Oliveira de Química, sobre Polímeros de adição – neopreno poliisopreno e polibutadieno pertencente ao módulo de Polímeros e aprenda mais sobre o assunto.
-
Cadastre-se
Polímeros de condensação – nylon, PET, e Kevlar
Assista esse vídeo com o Prof. Wagner Oliveira de Química, sobre Polímeros de condensação – nylon, PET, e Kevlar. pertencente ao módulo de Polímeros e aprenda mais sobre o assunto.
Radioatividade
-
Cadastre-se
Introdução à radioatividade, características das partículas alfa, beta e gama
Assista esse vídeo com o Prof. Jota Façanha de Química, sobre Introdução à radioatividade, características das partículas alfa, beta e gama pertencente ao módulo de Radioatividade e aprenda mais sobre o assunto.
-
Cadastre-se
Leis da radioatividade e reações de transmutação artificial
Assista esse vídeo com o Prof. Jota Façanha de Química, sobre transmutações.
Química ambiental
Resumo
Química ambiental Dentre os diversos problemas relacionados à química ambiental vamos discutir de forma sucinta três: efeito estufa (aquecimento global), destruição da camada de ozônio e chuva ácida. 1. Efeito estufa O efeito estufa é um processo que ocorre naturalmente. Parte da luz solar que é refletida da superfície terrestre fica retida na ...
Cálculo estequiométrico
Resumo
Cálculo estequiométrico O cálculo estequiométrico é a parte da química que faz um estudo quantitativo das reações químicas. Estuda as relações entre massas, volumes, números de mols, números de moléculas e números de átomos, principalmente. 1. Principais relações estequiométricas Para efetuar o cálculo estequiométrico podemos seguir as ...
Eletroquímica
Resumo
Eletroquímica A eletroquímica estuda as relações entre as reações químicas e a eletricidade. Ela está muito presente no nosso cotidiano porque as pilhas e baterias funcionam a partir de processos eletroquímicos de oxirredução. Basicamente vamos estudar dois tipos de sistemas na eletroquímica: a) Pilhas, Baterias ou Células Galvânicas Energia ...
Ligações químicas
Resumo
Ligações químicas Teoria do octeto “Todos os elementos buscam formas de adquirir distribuições eletrônicas iguais às dos gases nobres para conseguir estabilidade química” 1. Ligações iônicas Ocorre entre íons de cargas opostas que são formadas a partir de metais (cátions) e ametais (ânions). Observe o esquema abaixo onde M é metal e X é ...





























